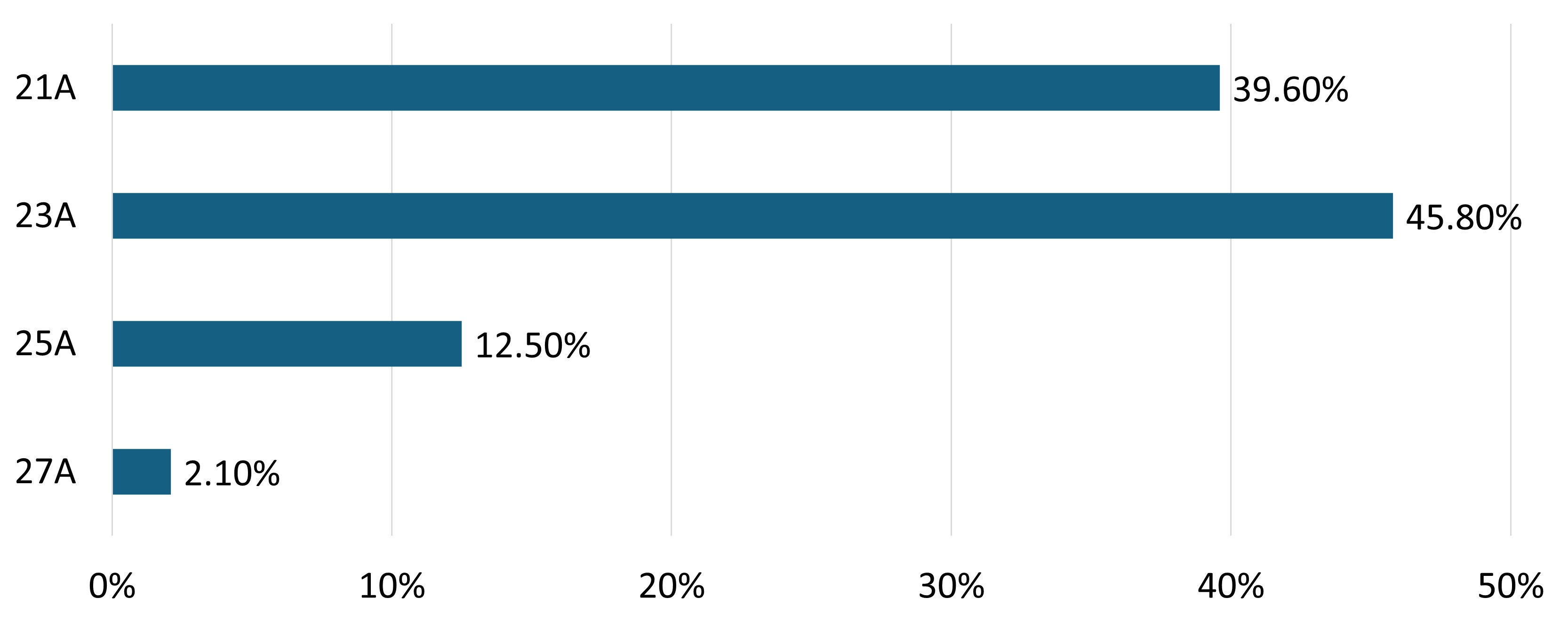2024年8月7日,上海欣吉特生物科技有限公司正式向歐盟遞交了自研產品“牛心包人工心臟瓣膜”(“欣瓣膜”)的 CE MDR 認證申請,標志著公司在國際化之路上邁出了一大步,具有里程碑式意義。
2018年10月,由比利時魯汶大學醫學院(KU Leuven)院長Dr. Paul Herijger"完成了首例“欣瓣膜”的 CE Mark 患者植入。此后,公司相繼在比利時、德國、波蘭等國家的多家歐洲知名醫院開展了臨床試驗,均取得了滿意的研究結果,為此次成功遞交 MDR 認證申請奠定了堅實基礎。
為研究“欣瓣膜”主動脈瓣生物瓣膜的有效性和安全性,自2018年起開展了這項前瞻性、國際多中心、單臂臨床試驗。基線數據顯示(在基線時),患者中 62.5% 為男性,37.5% 為女性。男性和女性患者的平均年齡分別為 70.9(60.0-82.0)歲和 71.7(63.0-81.0)歲,術前平均 EuroScoreII 評分為 1.91。其中使用 23A 型號的主動脈瓣膜患者最多,約占 45.8%,其次較多的是 39.6% 的患者使用了 21A 型號。術前 75% 的患者評分為 NYHA III 級,在瓣膜置換術后一個月降至1.4%。(圖1、圖2)
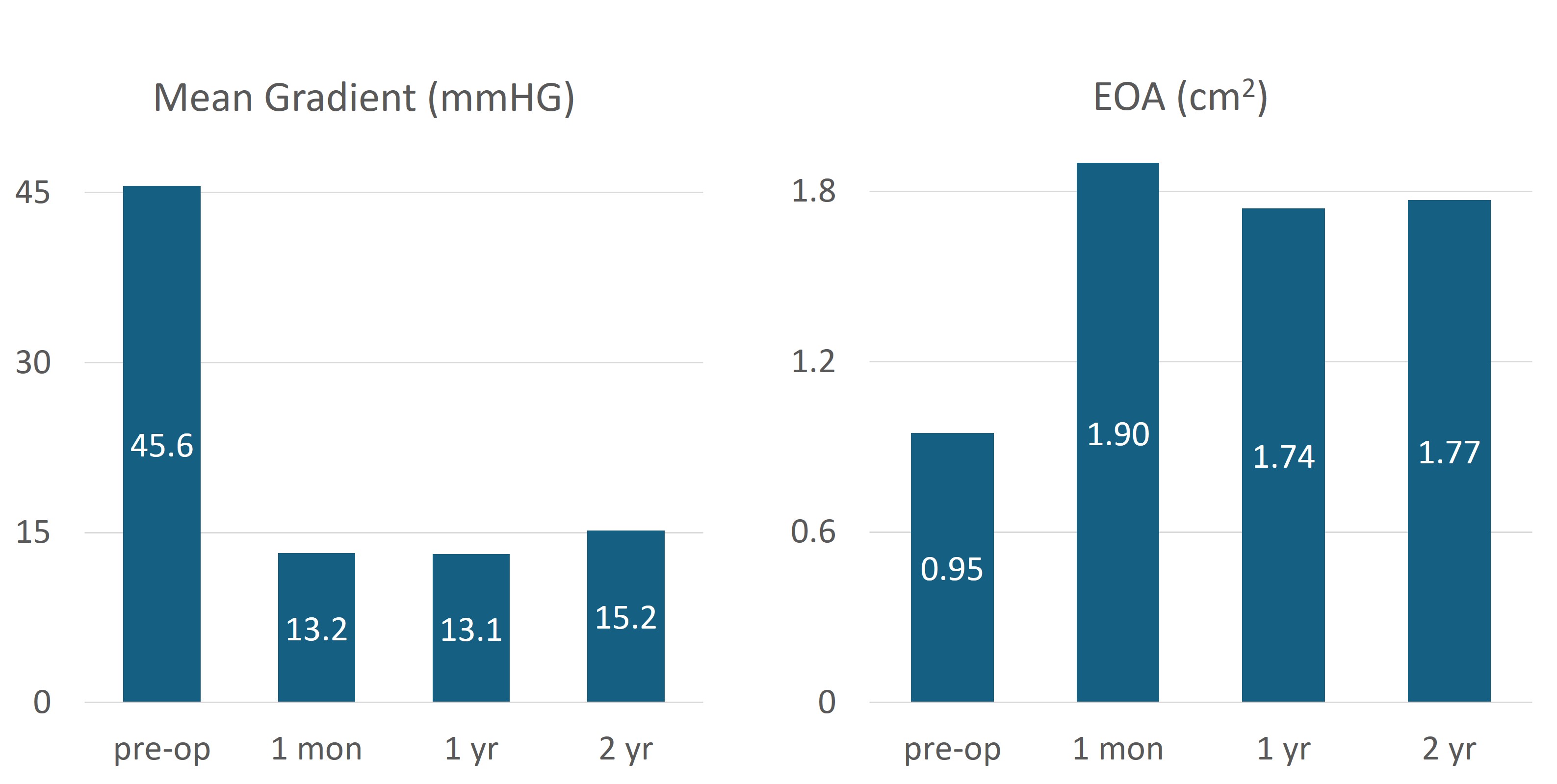
主要有效性終點方面,術后1個月隨訪時,患者主動脈瓣口平均開口面積從術前 0.95cm2 增加到 1.9cm2,隨著時間的推移,這些數據結果是一致的,術后 2 年的平均瓣口面積達 1.77cm2。同樣,患者主動脈瓣平均跨瓣壓差從術前 45.6 mmHg 降低到術后1個月的 13.1 mmHg,且隨著時間的推移,該結果也具有一致趨勢。(圖3)
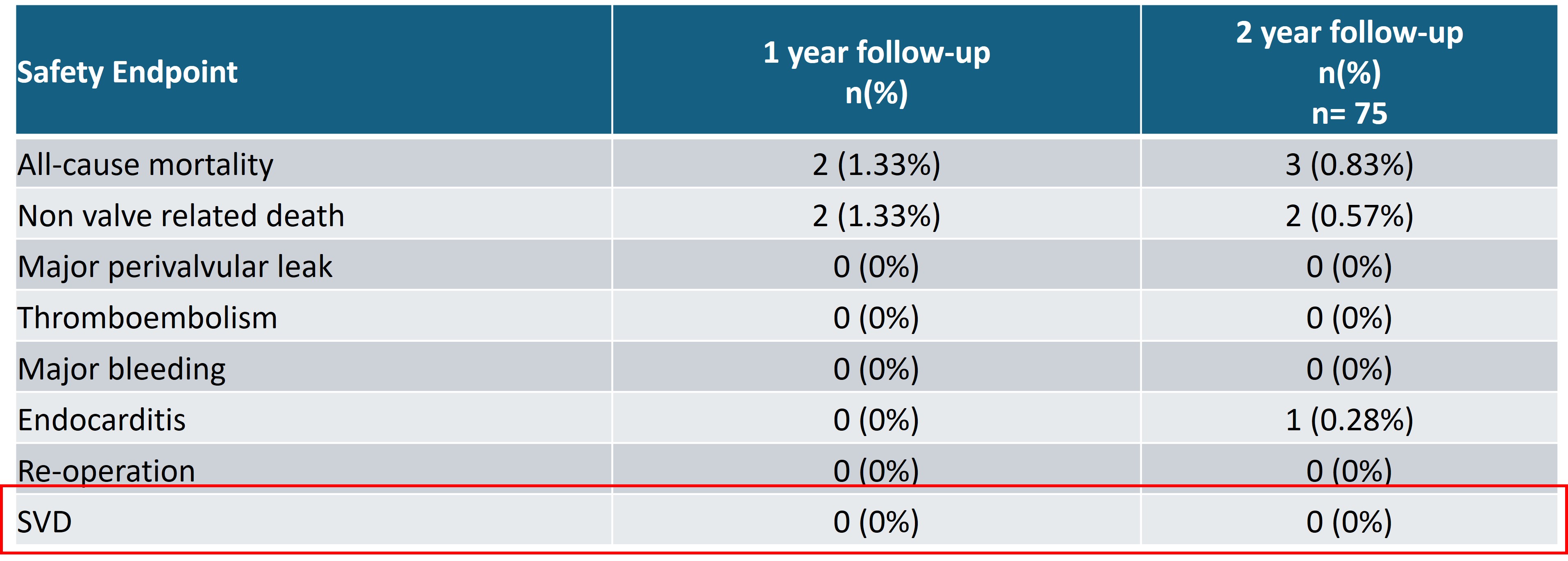
安全性終點方面,瓣膜術后 2 年全因死亡率僅為 3 例,分別為尿膿毒癥(1例),動脈瘤破裂(1例),結腸扭轉導致的心臟驟停(1例),均與瓣膜無關。術后 2 年均未出現再次手術事件,且無瓣膜結構性衰敗。(圖4)
“欣瓣膜”是一款設計經典的外科環上生物瓣膜,相較于傳統的機械瓣膜,有著無需終身服用抗凝藥物等優勢,且更適應亞洲人群小瓣竇的解剖學特點,相同尺寸擁有更大的有效開口面積(EOA),可為患者未來瓣中瓣(VIV)預留足夠空間。此外,該產品還改善了二尖瓣中心返流等現象,薄瓣腳、軟縫環的結構設計,更有助于微創小切口手術的使用。
截至目前,該產品在海內外已累計完成超 5,000 例臨床應用,其安全性和有效性得到了國內外廣大專家們的一致認可和贊譽。國內由復旦大學附屬中山醫院牽頭的前瞻性、多中心、單臂 5 年臨床研究結果數據證明,其臨床效果媲美國際頂尖產品。
Cingular是一款設計經典的環上生物瓣膜,該產品突破性的解決了臨床上生物瓣膜開口面積(EOA)較小、容易發生人工瓣膜-病人不匹配(PPM)的問題,其相同型號瓣膜的有效開口面積(EOA)較同類產品平均增加30%~50%,且小瓣優勢更明顯,更適應亞洲人群小瓣竇的解剖學特點。
與傳統機械瓣相比,生物瓣膜有著無需終身服用抗凝藥物和高質量的術后生活等優勢。據悉,國內生物瓣膜應用比例約20%-30%,臨床上往往追求更大的EOA為小瓣患者(約占30%)使用機械瓣,而“欣瓣膜“更大的開口面積不僅為這部分小瓣患者提供了使用生物瓣的機會,更為年輕患者未來瓣中瓣(VIV)預留足夠的空間,使患者能夠終身受益。
欣吉特生物董事長楊軍博士寄語
欣吉特創立以來,布局海外市場一直是公司發展的重要戰略方向。此次正式遞交 CE MDR 申請,意味著欣吉特的國際化目標又向前邁出了堅實的一大步。未來,在提升現有產品國際競爭力的同時,我們還將加大創新研發力度產品,以適應不同國家、不同患者人群的醫療需求。相信很快,國外的瓣膜病患者就能用上來自中國的全新解決方案。30余年心臟瓣膜研發經歷,曾擔任國際巨頭瓣膜公司首席研發科學家
美國Case Western Reserve University生物醫學工程博士
中國食品藥品檢定研究院醫療器械檢定所瓣膜工作組專家
中國藥監局心血管植入物分技術委員會專家委員
歐洲主要臨床研究者之一Dr. Krzysztof Bartus寄語
我與欣吉特結緣于2018年,此后,我們共同開啟了一段愉快的臨床研究之旅,這是中國本土研發的外科生物瓣膜產品首次在歐洲開展的多中心臨床研究,讓我切身感受到了中國“智”造在歐洲應用的無限前景。這款瓣膜具有較大的有效開口面積(EOA),不僅有助于延長瓣膜的使用壽命、降低再次手術風險,還能夠提高患者的生活質量和滿意度。我祝賀欣吉特公司團隊完成了這項具有里程碑意義的研究。
Krzysztof Bartus博士簡介

歐洲心胸外科協會/心臟病學會委員成員、波蘭心胸外科醫師協會/波蘭心臟病學會委員成員
循環、循環心血管介入、波蘭心臟雜志、歐洲心
血管外科雜志國際醫學期刊審稿人,迄今已發表200多篇學術論文
欣吉特生物成立于2010年,是一家致力于研發、生產和銷售生物類供人體植入高端醫療產品的高新醫療企業。目前公司取得 NMPA 的產品包括硬腦(脊)膜補片、牛心包生物瓣膜以及心外科生物補片。公司仍致力于研發與創新,前瞻性地布局了一系列高附加值的產品,為微創外科手術開發了新型免縫合主動脈瓣,在介入瓣領域,選擇開發難度較大的經導管二尖瓣置換產品。此外,欣吉特生物還積極布局了多條心外科補充產品線,將形成一套完整的“產品矩陣”。此次 CE MDR 認證的遞交,不僅彰顯了公司實力和市場潛力,也預示著欣吉特生物即將邁向更廣闊的全球市場,直面全球競爭!

MDR 是醫療設備和配件投放歐洲市場時,制造商需要遵守執行的法規,自2021年5月起,只有獲得 CE 標志批準后,方可在歐洲經濟區的 30 個國家/地區銷售產品設備。CE 標志是一種安全認證標志,在歐盟市場屬于強制性認證,無論是歐盟內部企業生產的產品,還是其他國家生產的產品,想在歐盟市場自由流通,就必須加貼“CE”標志,以表明其符合歐盟《技術協調與標準化新方法》法規的基本要求。